Một oxit axit của lưu huỳnh ký hiệu ( So3) cho tác dụng với nước ( H2O) phương trình phản ứng hóa học này diễn ra như thế nào? Mời xác bạn cùng theo dõi phương trình SO3 + H2O tại đây nhé!
Cân bằng phương trình So3 + h2o
SO3 là một oxit axit của lưu huỳnh được điều chế bằng cách cho lưu huỳnh tác dụng với oxi ở điều kiện thích hợp.
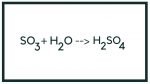
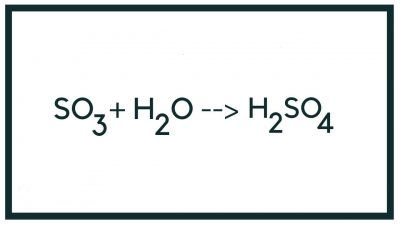
H2O + SO3 ➙ H2SO4
Lưu Huỳnh Trioxit + Nước = Axít Sunfuric
| H2O | + | SO3 | ⟶ | H2SO4 | |
| lỏng | lỏng | dd | |||
| không màu | không màu | không màu |
Hiện tượng : Lọ chứa dung dịch sau khi phản ứng sẽ nóng lên do tỏa nhiệt
Để điều chế được H2SO4 từ SO3 thì chúng ta dẫn luồng khí SO3 vào dung dịch chứa nước sạch là được. Phản ứng tạo thành H2SO4 không cần điều kiện xúc tác gì cả. Tuy nhiên, để thu được dung dịch H2SO4 có nồng độ đậm đặc thì tỷ lệ SO3 càng cao thì H2SO4 tạo thành càng nhiều.
Để điều chế được H2SO4 trong phòng thí nghiệm chúng ta sẽ dẫn luồng khí SO3 thu được vào dung dịch nước tinh khiết cong trong công nghiệp thì sẽ có dàn phun nước xuống một buồng chứa toàn SO3 vừa mới tạo thành.
Bài tập ví dụ liên quan So3 và H2o
Ví dụ 1 : Hòa tan hết m gam SO3 vào nước thu được 196 gam dung dịch axit sunfuric có nồng độ 15%. Khối lượng m gam SO3 là
A. 20g
B. 15g
C. 25g
D. 10g
Lời giải
nH2SO4= mH2SO4/MH2SO4= (196.12,5/100)/98 = 0,25 (mol)
⇒ nSO3= nH2SO4 = 0,25 (mol)
⇒ mSO3 = 0,25.80 = 20 g
Chọn đáp án : D
Ví dụ 2 : Sơ đồ điều chế H2SO4 trong công nghiệp là:
A. FeS2 → SO2 → SO3 → H2SO4
B. S → SO2 → SO3→ H2SO4
C. FeS2→ S → SO2 → SO3→ H2SO4
D. S → H2S →SO2 → SO3 → H2SO4
Lời giải :
Chọn đáp án A