Trong bảng tuần hoàn hóa học thì Nhôm được kí hiệu là Al hóa trị mấy? Đây là những câu hỏi thường gặp trong các bài tập hóa học, vậy al hóa trị mấy? Nguyên tử khối của Al và phân tử khối của Al ( nhôm) … Tất cả sẽ được giải đáp ngay sau đây.
Al hóa trị mấy?
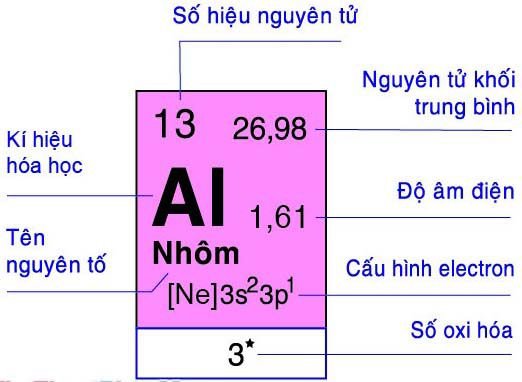
Nhôm là nguyên tố phổ biến trong vỏ trái đất, ứng dụng của nhôm trong thực tế cũng được sử dụng rất nhiều vì vậy các ký hiệu hóa học và thành phần hóa học, hóa trị của al các bạn cần lắm rõ .. Trong bảng tuần hoàn hóa học, kim loại nhôm ở vị trí số 13, chu kỳ 3 và thuộc nhóm IIIA.
- Kí hiệu Nhôm là : Al
- Hóa trị của Nhôm ( Al ) là : III
- Al thuộc ô 13, chu kì 3, nhóm IIIA
Nguyên tử khối và phân tử khối của Al
Các đặc điểm chú ý của kim loại Nhôm ( Al ) trong thực tế cũng như trong các ứng dụng vào thực tế như sau:
Nhôm nằm ở vị trí số 13 trong bảng tuần hoàn hóa học
Nguyên tử khối của Al bằng 27 đvC.
Khối lượng riêng của A là 2,7 g/cm³
Nhiệt độ nóng chảy của nhôm là 660ºC.
Nhôm là kim loại thường thấy phía bên trong vỏ trái đất (chiếm khoảng 8%). Trong tự nhiên, nhôm thường có trong các hợp chất như đất sét, boxit hay criolit
- Trong đất sất sét, nhôm thuộc hợp chất: Al2O3.2Sio2.2H2O
- Trong mica: K2O.Al2O3.6Sio2.2H2O.
- Trong Boxit: Al2O3.nH2O
- Trong criolit Criolit: 3NaF.AlF3 hay (Na3AlF6).
Tính chất của nhôm
Các tính chất cơ bản của nhôm như nhôm chính là kim loại nhẹ. So với sắt thép, nhôm chỉ nặng ⅓ trọng lượng. Điều này sẽ giải thích vì sao nhôm luôn được dùng nhiều trong các ngành chế tạo các thiết bị cần quan tâm đến trọng lượng như cửa, máy bay, linh kiện trên không, máy móc.
Nhôm có thể dẫn được điện. Mặc dù tính dẫn điện kém hơn đồng nhưng nhôm được sử dụng phổ biến khi dùng để truyền cùng dòng điện.
Nhôm có tính dẻo. Tính dẻo tạo sự thuận tiện trong sản xuất ra các sản phẩm có dạng tấm, lá, băng hoặc là ép chảy thành các thanh như khung cửa. Khung cửa nhôm các loại hiện nay trên thị trường rất phổ biến.
Một trong những nhược điểm chính không tốt của nhôm đó chính là độ cứng và độ bền khá thấp. Giá trị sử dụng không cao và dễ hư hỏng sau một thời gian dài.
Tác dụng với các phi kim
Nhôm phản ứng được với oxi trên bề mặt. Vì khi phản ứng, nhôm sẽ tạo ra một lớp màng oxit bao phủ bề mặt. Qua đó bảo vệ và ngăn cản nhôm tác dụng với oxi để tạo ra oxit.
2Al + 3O2 => Al2O3
Al2O3 là một oxit lưỡng tính, vì thế tính chất hóa học của Al2O3 sẽ thuộc dạng một oxit lưỡng tính. Tức là nó có thể phản ứng với cả axit và bazơ.
Tác dụng với nước
Trên thực tế, Al sẽ không phản ứng được với nước vì được bảo vệ bởi lớp oxit mỏng. Khi lớp oxit được phá bỏ, nguyên tố al phản ứng trực tiếp với nước.
2Al + 6H2O => 2Al(OH)3 + 3H2
Tác dụng với oxit của kim loại kém hoạt động hơn (phản ứng nhiệt nhôm)
Al có thể khử được oxit của các kim loại đứng sau nó trong dãy hoạt động hóa học: 2Al + 3FeO => Al2O3 + 3Fe
Tác dụng với dung dịch axit
Với các axit khác nhau, nhôm sẽ có phản ứng khác nhau.
Tác dụng với dung dịch bazơ
Al có thể dễ dàng tham gia những phản ứng với các dung dịch kiềm: Al + NaOH + H2O => NaAlO2 + 1,5 H2
Tác dụng với dung dịch muối
Al có thể đẩy được kim loại đứng sau trong dãy hoạt động kim loại ra khỏi dung dịch muối của chúng: 2Al + 3CuSO4 => Al2(SO4)3 + 3Cu
Như vậy với bài viết này các bạn có thể phần nào hiểu rõ chi tiết về hóa trị, số nguyên tố, nguyên tử khối và phân tử khối của Nhôm, kí hiệu Al nhé!

