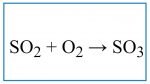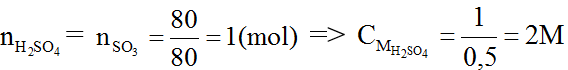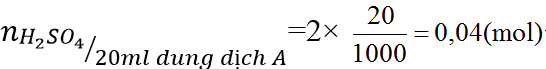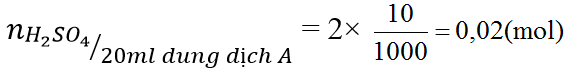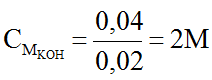Từ Lưu Huỳnh Ddioxxit ( SO2 ) cho tác dụng với chất gì để tạo ra chất Lưu Huỳnh Trioxit (SO3), các bạn có thể xem phương trình phản ứng hóa học SO2 ra SO3 đầy đủ như sau:
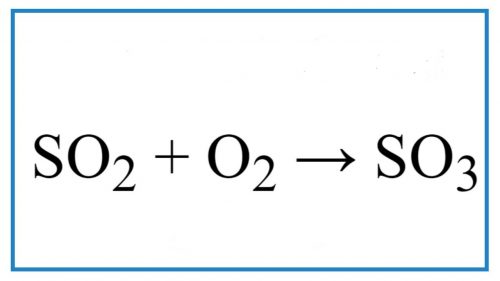
SO2 ra SO3 viết phản ứng hóa học.
2SO2 + O2 = 2SO3
- SO2 : Khí lưu huỳnh đioxit
- O2 : Khí Oxi
- SO3 : Khí lưu huỳnh trioxxi
Điều kiện phản ứng : Nhiệt độ 450°C, xúc tác: V2O5
Oxi hóa SO2 bằng khí oxi hoặc không khí dư ở nhiệt độ 450 – 500ºC, chất xúc tác vanađi (V) oxit V2O5 giải phóng ra khí SO3.
Bài tập có chứ SO2 và SO3
Bài 1 : Cho 80 gam SO3 vào một cốc nước sau đó thêm nước vào đến vạch 0,5 lít thì dừng (gọi là dung dịch A).
a) Tính nồng độ mol/l của dung dịch A.
b) Cho 20 ml dung dịch A vào dung dịch BaCl2 dư. Hãy tính khối lượng kết tủa thu được.
c) Để trung hòa 20ml dung dịch KOH thì cần 10ml dung dịch A. Tính nồng độ mol/l của dung dịch KOH.
Hướng dẫn:
Ta có: nSO3 = 80/80 = 1
SO3 + H2O → H2SO4 (1)
(mol) 1 → 1
Từ (1) ⇒
Phản ứng:
H2SO4 + BaCl2 → BaSO4 ↓+ 2HCl (2)
(mol) 0,04 → 0,04
Ta có:
Từ (2) ⇒nBaSO4= 0,04(mol) ⇒ mBaSO4=0,04 × 233=9,32 (gam)
Ta có:
2KOH + H2SO4 → K2SO4 + 2H2O (3)
(mol) 0,04 ← 0,02
Từ (3) ⇒ nKOH = 0,04 (mol) ⇒
Bài 2 : Hấp thụ V lít SO2 (đktc) vào 300 ml dung dịch Ba(OH)2 1M thu được 21,7g kết tủa. Tính V
Lời giải
Trường hợp 1: Ba(OH) 2dư, SO2 hết , nSO2 = n BaSO3
Ba(OH) 2 + SO2 → BaSO3 ↓+ H2O
0,1 ←0,1
→ VSO2 = 0,1. 22,4 = 2,24 lít
Trường hợp 2: Ba(OH) 2hết, SO2dư nhưng không hòa tan hết kết tủa ( kế t tủa chỉ tan một phần)
a(OH) 2 + SO2 → BaSO3↓+ H2O
0,1 0,1 ←0,1
Ba(OH) 2 + 2SO2 → Ba(HSO3) 2
( 0,3 – 0,1) → 0,4
→ nSO2 = 0,1 + 0,4 = 0,5 mol
→ VSO2 = 0,5. 22,4 = 11,2lít
(tính nhanh nSO2 = 2nBa(OH)2 – n↓ = 2. 0,3 – 0,1 = 0,5 mol)
Bài 3 : Dẫn khí SO2 vào dung dịch KMnO4 có hiện tượng gì xảy ra
A. Dung dịch bị mất màu
B. Dung dịch bị mất màu tím của thuốc tím KMnO4
C. Xuất hiện kết tủa màu trắng
D. Mất màu dung dịch da cam ban đầu
Dẫn khí SO2 vào dung dịch KMnO4 màu tím nhận thấy dung dịch bị mất màu, vì xảy ra phản ứng hóa học sau:
5SO2 + 2KMNO4 + 2H2O → 2MnSO4+ K2SO4 + 2H2SO4
Đáp án : B