Cho phản ứng hóa học giữa các chất Natri Hidroxit (NaOH) kết hợp với Axit Photphoric (H3PO4) kết quả sau phản ứng này thu được các chất nào các bạn cùng xem cân bằng phương trình H3PO4 + NaOH đầy đủ tại đây.
Bạn có thể quan tâm : Ag + HNO3
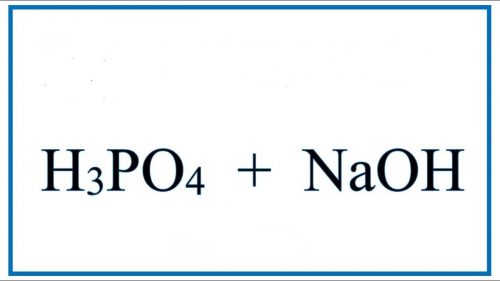
H3PO4 + NaOH Cân bằng phương trình phản ứng.
3NaOH + H3PO4 → 3H2O + Na3PO4
Trong đó
- NaOH : Natri Hidroxit
- H3PO4 : Axit Photphoric
- H2O : Nước
- Na3PO4 : Natri Photphat
Điều kiện phản ứng : Không có
Hiện tượng nhận biết : Chất sản phẩm H2O (nước) và Na3PO4 (natri photphat) sinh ra. Chất tham gia NaOH (natri hidroxit) và H3PO4 (axit photphoric) dần biến mất.
Xem thêm : K3PO4 AgNO3
Bài tập có NaOH và H3PO4
Bài 1 : Cho 100 ml dung dịch H3PO4 tác dụng với 200 ml dung dịch NaOH a M thu được 1,2 gam muối NaH2PO4 và 1,42 mol Na2HPO4. Giá trị của a là:
Lời giải
nNa2HPO4 = 0,01 mol; nNaH2PO4 = 0,01 mol; nNaOH = 0,01 + 0,01.2 = 0,03 mol ⇒ a = 0,03/0,2 = 0,15 M
Bài 2 : Cho 44 gam NaOH 10% tác dụng với 10 gam axit H3PO4 39,2%.
a. Muối thu được là muối gì?
b. Tính nồng độ phần trăm muối trong dung dịch sau phản ứng
Lời giải
Số mol NaOH là nNaOH = 44.10/100.40 = 0,11 mol
Số mol H3PO4 là nH3PO4 = 10.39,2/100.98 = 0,04 mol
T = 0,11/0,04 = 2,75 mol ⇒ tạo ra 2 muối Na2HPO4 và Na3PO4
Phương trình phản ứng:
2NaOH + H3PO4 → Na2HPO4 + 2H2O
3NaOH + H3PO4 → Na3PO4 + 3H2O
Ta có : x + y = 0,04 (1) và 2x + 3y = 0,11 (2) ⇒ x = 0,01 và y = 0,03 mol
⇒nNa2HPO4 = 0,01 mol và nNa3PO4 = 0,03 mol
mNa2HPO4 = 0,01.142 = 1,42 gam; mNa3PO4 = 0,03.164 = 4,92 gam
mdd = 44 + 10 = 54 gam
Nồng độ phần trăm của các muối trong dung dịch sau phản ứng là:
C%( Na2HPO4) = 1,42/54.100% = 2,63%; C%( Na3PO4) =4,92/54.100% = 9,11%

