Kẽm kí hiệu là ZN kết hợp với nước (H2O) phản ứng tạo ra là gì? Mời các bạn cùng theo dõi cân bằng phương trình hóa học ZN + H2O chi tiết tại đây.
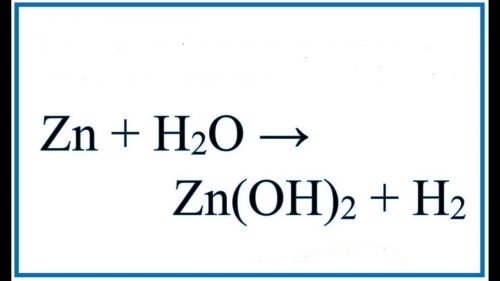
ZN + H2O Cân bằng phương trình hóa học.
Công thức điều chế Zn
Kẽm kim loại được sản xuất bằng luyện kim khai khoáng. Sau khi nghiền quặng, phương pháp tuyển nổi bọt được sử dụng để tách các khoáng dựa vào tính dính ướt khác nhau của chúng. Ở bước cuối cùng này thì kẽm chiếm 50%, phần còn lại là lưu huỳnh (32%), sắt (13%), và SiO2 (5%).
Công đoạn thiêu kết sẽ chuyển kẽm sulfua thành kẽm ôxít
2ZnS + 3 O2 → 2 ZnO + 2 SO2
– Sau đó, người ta có thể dùng 2 phương pháp cơ bản trong luyện kim là nhiệt luyện (pyrometallurgy) hoặc điện phân (electrowinning). Quá trình nhiệt luyện khử kẽm ôxít với cacbon hoặc cacbon mônôxít ở 950 °C (1.740 °F) thành kim loại kẽm ở dạng hơi. Hơi kẽm được thu hồi trong bình ngưng. Quá trình được biểu diễn theo các phương trình dưới đây:
2ZnO + C → 2 Zn + CO2
2ZnO + 2 CO → 2 Zn + 2 CO2
Quá trình điện phân, tách kẽm từ quặng tinh bằng axít sulfuric.
ZnO + H2SO4 → ZnSO4 + H2O
Sau đó, người ta dùng phương pháp điện phân để sản xuất kẽm kim loại
2 ZnSO4 + 2 H2O → 2 Zn + 2 H2SO4 + O2
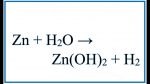
Khi cho Zn tác dụng với nước ta thu được phương trình được cân bằng như sau:
H2O + Zn → H2 + Zn(OH)2
Trong đó
- H2O : Nước
- Zn : Kẽm
- H2 : Hidro
- Zn(OH)2 : Kẽm Hidroxit
Điều kiện phản ứng : Không có
Hiện tượng xảy ra : Chất rắn kẽm (Zn) xám nhạt tan dần và xuất hiện vẫn đục do dung dịch Kẽm hidroxit (Zn(OH)2) ít tan.