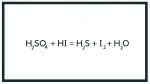
Trong phản ứng hóa học ta cho axit sulfuric ( H2SO4) tác dụng với axit iodic (HI) chất thu được sau phản ứng sẽ là gì và hiện tượng xảy ra như thế nào? Mời các bạn cùng theo dõi cân bằng các phương trình HI + H2SO4 như sau :
– Xem thêm : K2O + H2SO4
HI + H2SO4 các phản ứng xảy ra.
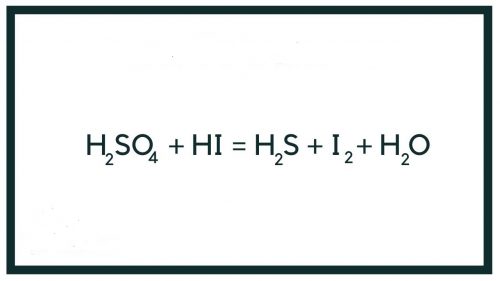
Hi + H2SO4 điều kiện bình thường
H2SO4 + 2HI → 2H2O + I2 + SO2
Trong đó
- H2SO4 : Dung dịch axit Sulfuric đậm đặc không màu
- HI : Axit Iodic
- H2O : Nước
- I2 : Iot
- SO2 :Khí Lưu huỳnh đioxit không màu có mùi hắc.
Điều kiện phản ứng : Không có
Hiện tượng nhận biết : Có khí mùi hắc SO2 thoát ra.
Hi + H2So4 điều kiện nhiệt độ
H2SO4 + HI → H2O + H2S + I2
- H2SO4 : Dung dịch axit Sulfuric đậm đặc
- HI : Axit Iodic
- H2O : Nước
- I2 : Iot
- H2S :Khí Hidro Sulfua không màu.
Điều kiện phản ứng : nhiệt độ
Hiện tượng nhận biết : Quan sát chất sản phẩm H2O (nước) (trạng thái: lỏng) (màu sắc: không màu), H2S (hidro sulfua) (trạng thái: khí) (màu sắc: không màu), I2 (Iot) (trạng thái: rắn) (màu sắc: đen tím), được sinh ra, chất tham gia H2SO4 (axit sulfuric) (trạng thái: dd đậm đặc), HI (axit iodic), biến mất.
Bài tập liên quan Hi và H2SO4
Bài 1 : Cho 0,52 gam hỗn hợp 2 kim loại Mg, Al tan hoàn toàn trong dung dịch H2SO4 loãng dư thu được 0,336 lít khí ở đktc. Khối lượng muối sunfat thu được là:
A. 1,24gam B. 6,28gam C. 1,96gam D. 3,4gam.
Lời giải
Áp dụng nhanh công thức :
mmuối = mKL + mSO42- = 0,52+ 0,015. 96= 1,96 gam
Như vậy chọn đáp án: C
Ví dụ 2: Cho 13,428 gam một kim loại M tác dụng với dung dịch H2SO4 đặc nóng dư thu được V lít khí H2S ở đktc và dung dịch A. Cô cạn dung dịch A thu được 66,24 gam muối khan. V có giá trị là :
A. 2,4640lít B. 4,2112 lít C. 4,7488lít D. 3,0912lít
Lời giải
Áp dụng công thức : nH2S = 1/4. số mol gốc SO42- trong muối
nH2S = 1/4.[(66,24-13,428)/96] = 0,1375 mol => V= 0,1375. 22,4= 3,0912lít
Như vậy chọn đáp án : D