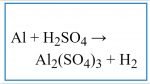Trong phương trình phản ứng hóa học hôm nay ta cho Nhôm( Al) tác dụng với axit sulfuric (H2SO4 loãng) và (H2SO4 đặc nóng) kế quả thi được sẽ như thế nào? Mời các bạn cùng xem phương trình đã cân bằng Al + H2SO4 đầy đủ nhất ở bài viết hôm nay.
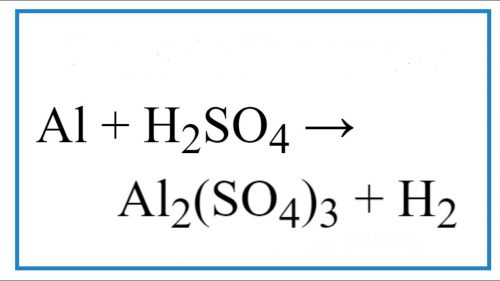
AL + H2SO4 Viết phương trình phản ứng.
Bạn có thể quan tâm : P + H2SO4
AL tác dụng H2SO4 loãng
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Trong đó
- Al : Chất rắn Nhôm màu trắng bạc
- H2SO4 : Dung dịch axit sulfuric loãng
- Al2(SO4)3 : Chất lỏng nhôm Sunfat không màu
- H2 : Khí Hidro không màu
Điều kiện phản ứng Al tác dụng H2SO4 loãng : Nhiệt độ phòng
Al tác dụng H2SO4 loãng hiện tượng : Kim loại bị hòa tan, đồng thời có bọt khí không màu bay ra
Al tác dụng với H2SO4 đặc nóng
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O
Trong đó
- Al : Nhôm
- H2SO4 : Axít Sunfuric ĐẶC NÓNG
- Al2(SO4)3 : Phèn nhôm Sunfat
- SO2 : Lưu Huỳnh Đioxit
- H2O : nước
Điều kiện phản ứng : Nhôm tác dụng với H2SO4đặc nóng
Hiện tượng sau phản ứng : Ta thấy Nhôm tan dần, xuất hiện khí không màu, có mùi hắc chính là lưu huỳnh đioxit (SO2)
Bài tập có chứ Al và H2SO4
Bài 1 : Dãy kim loại nào dưới đây tác dụng được H2SO4 đặc nguội?
A. Zn, Cu, Fe
B. Ni, Fe, Cu
C. Cu, Zn, Mg
D. Cu, Fe, Mg
Lời giải
Phương trình hóa học
Cu + 2H2SO4 → CuSO4 + SO2↑ + 2H2O
2Fe + 6H2SO4 → Fe2(SO4)3+ 3SO2↑ + 6H2O
4Mg + 5H2SO4 → 4MgSO4 + H2S + 4H2O
Chọn đáp án : C
Ví dụ 2: Cho a gam nhôm tác dụng với dung dịch H2SO4 (đặc, nóng, dư) sau khi phản ứng kết thúc người ta thu 13,44 lit khí SO2 (đktc). Giá trị a là
A. 2,7 gam
B. 10,8 gam
C. 8,1 gam
D. 5,4 gam
Lời giải
nSO2 = 13,44/22,4 = 0,6 mol
Phương trình hóa học
2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O
0,4 ← 0,6 mol
mAl = 0,4.27 = 10,8 gam
Chọn đáp án : B
Ví dụ 3 : Dùng m gam Al để khử hết 3,2 gam Fe2O3 (phản ứng nhiệt nhôm). Sản phẩm sau phản ứng tác dụng với lượng dư dung dịch NaOH tạo 1,344 lít khí (đktc). Giá trị của m là
A. 0,540 gam.
B. 0,810 gam.
C. 1,080 gam.
D. 1,755 gam.
Lời giải
nFe2O3 = 3,2/160 = 0,02 mol;
nH2 = 1,344/22,4 = 0,06 mol
2Al + Fe2O3 Al2O3 + 2Fe (1)
0,04 ← 0,02 mol
Khi Al dư thì:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 (2)
0,04 mol ← 0,06 mol
=> ∑nAl ban đầu = nAl (1) + nAl (2) = 0,04 + 0,04 = 0,08 mol
=> mAl= 0,08.27 = 2,16 gam
Chọn đáp án : C