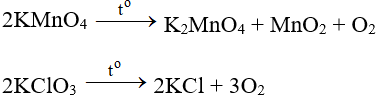Oxi là nguyên tố hóa học khá phổ biến trên trái đất. Xi có các tính chất vật lý và tính chất hóa học nào? Hay cách điều chế Oxi như thế nào? Các bạn cùng theo dõi bài viết hôm nay để lắm rõ kiến thức tính chất hóa học của Oxi nhé!
Xem thêm : Oxi hóa trị mấy
Nguyên tố oxi có số hiệu nguyên tử là 8, thuộc nhóm VIA, chu kì 2 của bảng tuần hoàn các nguyên tố hoá học.
Kí hiệu hóa học Oxi là : O
Công thức cấu tạo của phân tử oxi là O=O.
CTHH là : O2
Nguyên tử khối của Oxi: 16
Phân tử khối là: 32
Nguyên tử oxi có cấu hình electron là 1s22s22p4, lớp ngoài cùng có 6e.

Tính chất vật lý của Oxi
Tính chất của oxi là một chất không có mùi, không có màu sắc, không có vị. Oxi tan ít trong nước và có khối lượng nặng hơn không khí. Khi hóa lỏng sẽ có màu xanh nhạt.
Dưới áp suất khí quyển, oxi hoá lỏng ở nhiệt độ -183oC.
Khí oxi tan ít trong nước (100ml nước ở 20oC, 1 atm hoà tan được 3,1ml khí oxi. Độ tan của khí oxi ở 20oC và 1 atm là 0,0043 g trong 100g H2O).
Tính chất hóa học của Oxi
Oxi tác dụng với phi kim
O2 Với lưu huỳnh
Lưu huỳnh cháy trong không khí với ngọn lửa nhỏ, màu xanh nhạt; cháy trong khí oxi manh liệt hơn, tạo thành khí lưu huỳnh dioxit SO2 (còn gọi là khí sunfuro) và rất ít lưu huỳnh trioxit SO3
PTHH: S + O2 →to SO2
O2 với photpho:
Photpho cháy mạnh trong oxi với ngọn lửa sáng chói, tạo khói trắng dày đặc bám vào thành lọ dưới dạng bột tan được trong không khí. Bột trắng đó là điphotpho pentaoxit có CTHH là P2O5
PTHH: 4P + 5O2 →to 2P2O5
⇒ Vậy oxi có thể tác dụng với phi kim khi ở nhiệt độ cao. Trong hợp chất oxi hóa trị II
Oxi tác dụng với kim loại
Cho dây sắt cuốn một mẩu than hồng vào lọ khí oxi, mẩu than cháy trước tạo nhiệt độ đủ cao cho sắt cháy. Sắt cháy mạnh, sáng chói, không có ngọn lửa, không có khói, tạo ra các hạt nhỏ nóng chảy màu nâu là sắt (II, III) oxit, công thức hóa học là Fe3O4, thường được gọi là oxit sắt từ
PTHH: 4Fe + 2O2 →to Fe3O4
Oxi tác dụng với hợp chất
Khí metan (có trong khí bùn, ao, bioga) cháy trong không khí do tác dụng với oxi, tỏa nhiều nhiệt
PTHH: CH4 + 2O2 →to CO2 + 2H2O
Xem thêm : Tính chất hóa học của Hidro
Cách điều chế Oxi
Điều chế Oxi ở phòng thí nghiệm
Trong phòng thí nghiệm, khí oxi được điều chế bằng cách phân huỷ những hợp chất giầu oxi và ít bền đối với nhiệt như KMnO4 (rắn), KClO3 (rắn), …
Điều chế Oxi trong công nghiệp
- Điều chế O2 từ không khí: Không khí sau khi đã loại bỏ hết hơi nước, bụi, khí cacbon đioxit, được hoá lỏng. Chưng cất phân đoạn không khí lỏng, thu được oxi. Oxi được vận chuyển trong những bình thép có dung tích 100 lít dưới áp suất 150 atm.
- Điều chế Oxi từ nước: Điện phân nước (nước có hoà tan một ít H2SO4 hoặc NaOH để tăng tính dẫn điện của nước), người ta thu được khí oxi ở cực dương và khí hiđro ở cực âm.